一起來盤點lncRNA最新研究進展(20190404)
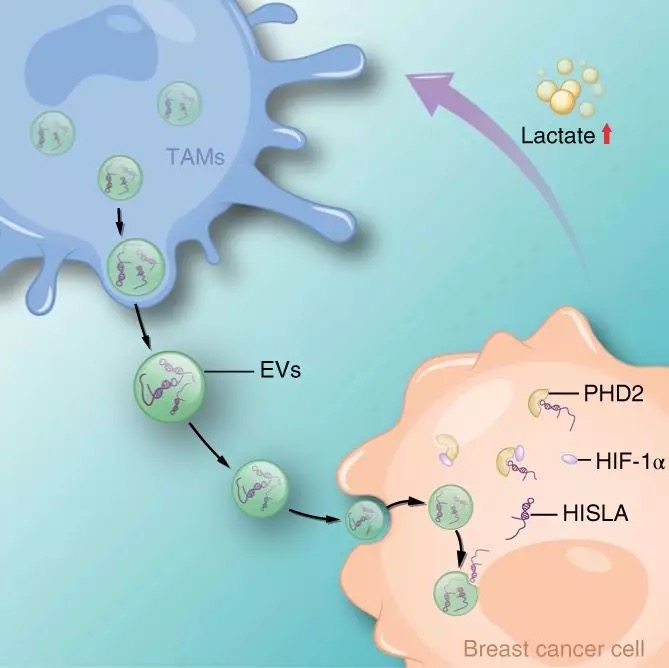
《Nature Cell Biology》:腫瘤相關(guān)巨噬細胞細胞外囊泡包裹的lncRNA調(diào)節(jié)乳腺癌細胞的有氧糖酵解
IF:19.064
2019-4-1
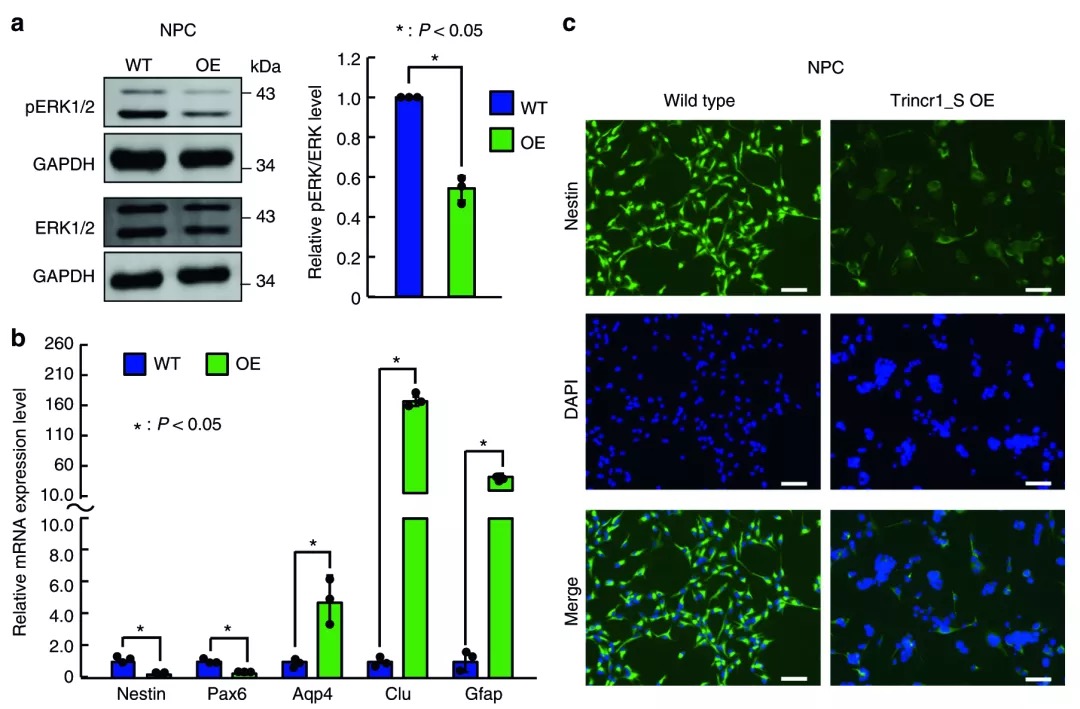
《Nature Communication》:TRIM71與lncRNA Trincr1結(jié)合抑制胚胎干細胞中的FGF/ERK信號傳導(dǎo)
IF:12.353
2019-3-25
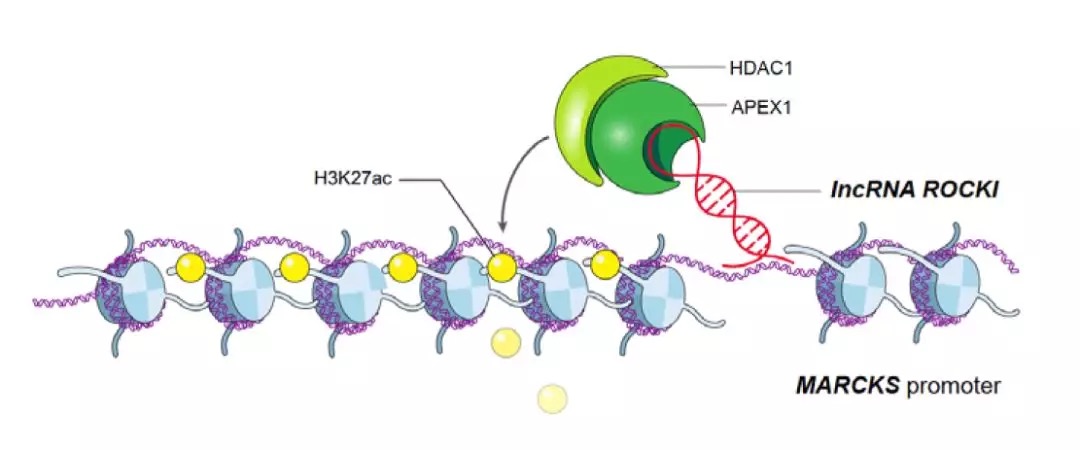
《The EMBO Journal》:長鏈非編碼RNA ROCKI調(diào)控炎癥基因表達
IF:10.557
2019-3-27
《PNAS》:抑制lncRNA SAF可激活HIV-1感染的人類巨噬細胞中的凋亡效應(yīng)因子caspases
IF:9.504
2019-3-27

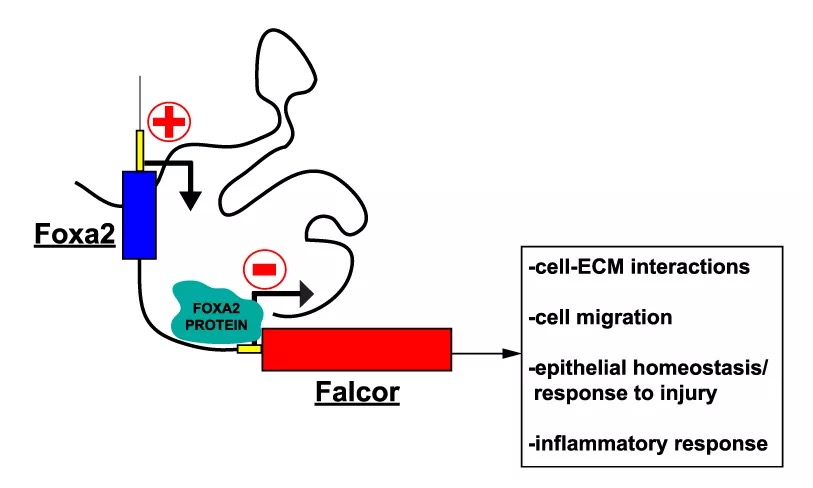
《Genes & Development》:lncRNA Falcor調(diào)控Foxa2的表達以維持肺上皮細胞穩(wěn)態(tài)并促進再生
IF:9.462
2019-3-28
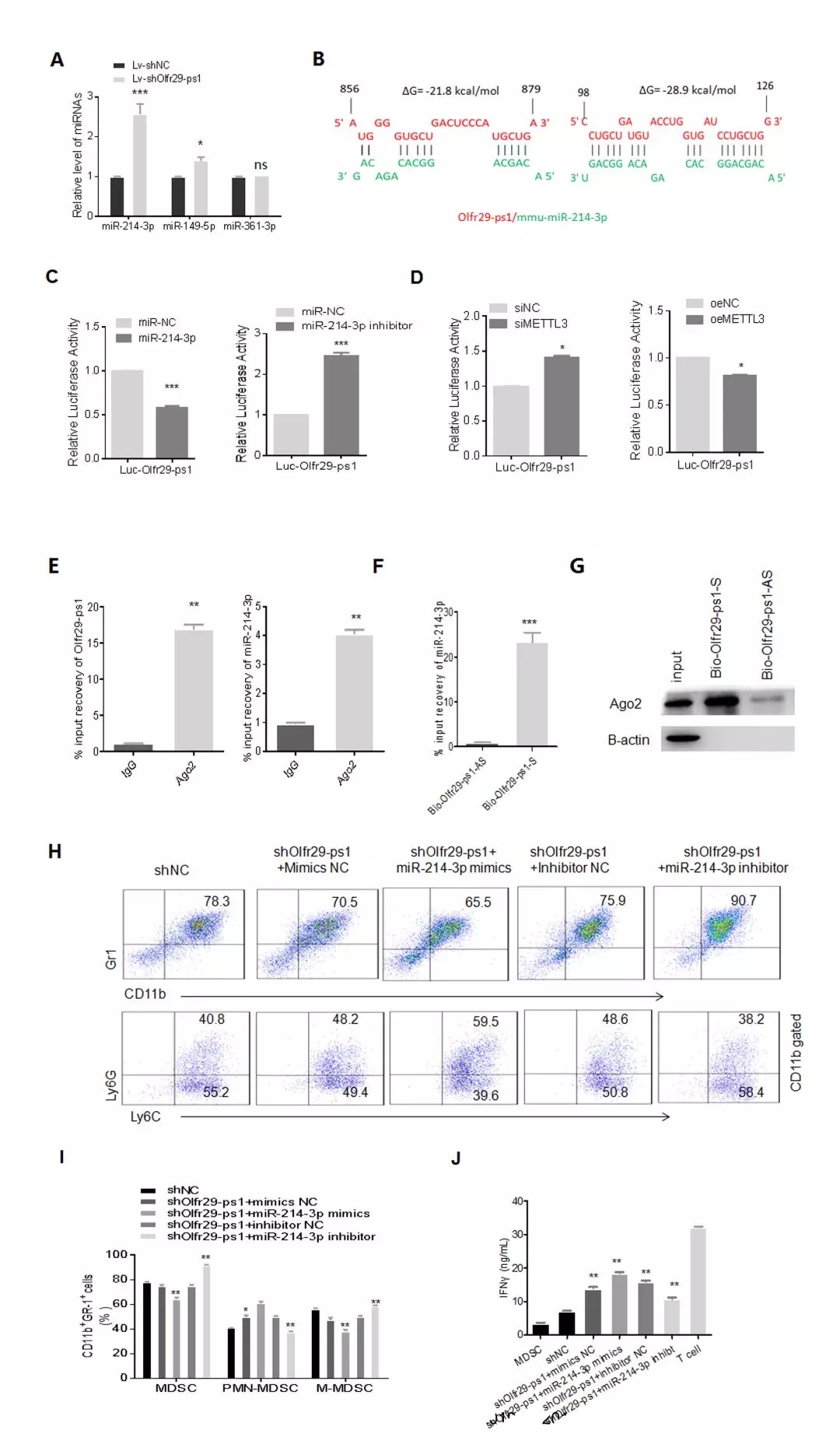
《Cancer Immunol Res》:假基因Olfr29-ps1促進單核細胞MDSC的抑制功能和分化
IF:9.188
2019-3-26
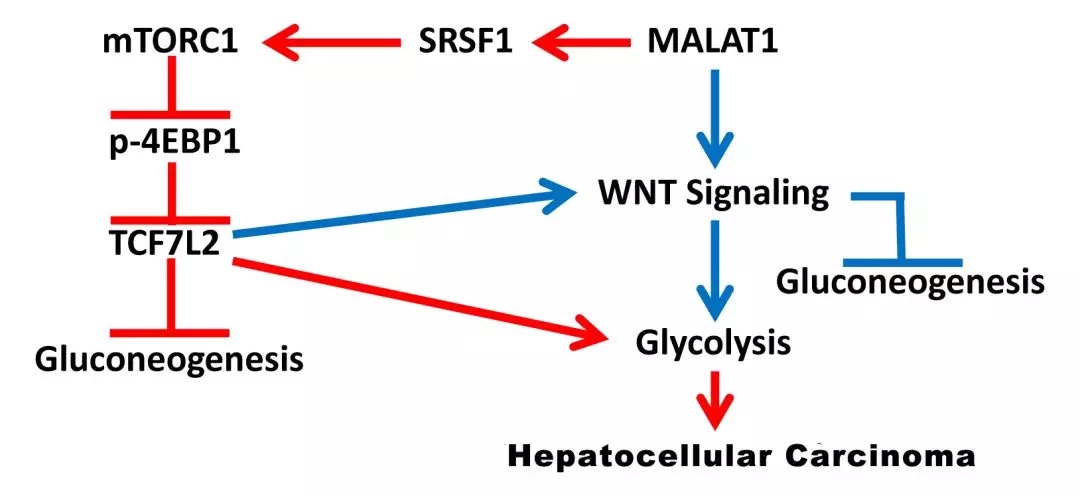
《Cancer Research》:lncRNA MALAT1通過增強mTOR介導(dǎo)的TCF7L2翻譯來調(diào)節(jié)癌癥葡萄糖代謝
IF:9.13
2019-3-26